一、晶体和非晶体
固体可以分为晶体和非晶体,它们的主要区别有三点:
(1)在外形上,晶体具有规则的几何外形,而非晶体则没有规则的几何外形.
食盐晶体、明矾晶体、石英晶体的形状虽然各不相同,但都有规则的几何形状,所以食盐、明矾、石英都是晶体.有些晶体可以具有多种不同的几何形状,例如雪花可以有多种不同的几何形状,非晶体则没有规则的几何形状.

(2)在物理性质上,晶体具有各向异性,而非晶体是各向同性的.
物理性质包括弹性、硬度、导热性能、导电性能、光的折射性能等.晶体的各向异性是指晶体在不同方向上的物理性质不同.例如晶体在不同的方向上可以有不同的硬度、弹性、导热性能、导电性能等.
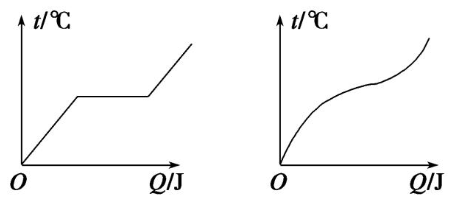
(3)晶体具有一定的熔点,而非晶体则没有一定的熔点.
晶体和非晶体是相对的,晶体和非晶体并不是绝对的,它们在一定条件下可以相互转化.
例如,天然水晶是晶体,而熔化以后再凝固的水晶(即石英玻璃)就是非晶体.有些非晶体在一定条件下也可以转化为晶体.
2.单晶体与多晶体
(1)单个的晶体颗粒是单晶体.
(2)多晶体是许多单晶体杂乱无章地组合而成.
(3)单晶体与多晶体的区别
①外形是否规则.单晶体有规则的外形,多晶体没有规则的外形.
②物理性质是各向异性还是各向同性.
单晶体在物理性质上表现为各向异性,而多晶体在物理性质上表现为各向同性.

(4)单晶体和多晶体的相同点
单晶体和多晶体都具有一定的熔点.
3.多晶体与非晶体
多晶体与非晶体的相同点:(1)都没有规则的几何外形;(2)在物理性质上都表现为各向同性.
多晶体与非晶体的区别:多晶体有一定的熔点,而非晶体则没有一定的熔点.

二、固体的微观结构
1.晶体的微观结构的特点
(1)组成晶体的物体微粒(原子、分子或离子)有规则地在空间排列成阵列,呈现周而复始的有序结构.
(2)晶体中物质微粒的相互作用很强,微粒的热运动不足以克服它们的相互作用而远离.
(3)微粒的热运动表现为在各自的平衡位置附近做微小的振动.
2.晶体的结合类型
(1)离子晶体:由正、负离子通过离子键结合而成的晶体.如NaCl、AgBr、PbS、MgO等.
(2)原子晶体:相邻原子之间通过共价键结合而成的晶体.如SiO2、金刚石、石墨、锗等.
(3)金属晶体:物质微粒通过金属键结合而成的晶体.如铜晶体、银、铝、镍、金等.
物质是由原子、分子、离子等微粒构成的.微粒间的相互作用(化学键或分子间相互作用)理论是物质构成的基本理论.基于这些理论,人们才能深入探讨物质的微观结构和宏观性质之间的关系,从而进一步认识并制备出各种具有特定化学组成和结构的物质.
3.同一种物质微粒在不同的条件下有可能生成不同的晶体
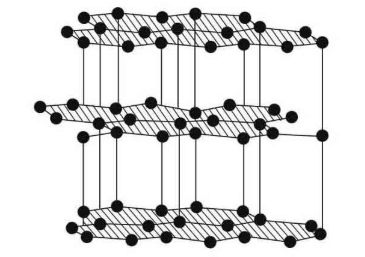
是因为它们的微粒能够按照不同的规则在空间分布.例如:金刚石和石墨都是由碳元素构成的,它们有不同的点阵结构,金刚石的晶体结构中每个碳原子周围都有4个碳原子,它们彼此之间的距离相等,原子间的作用力很强,硬度大,可以用来切割玻璃,钻入坚硬的岩石,金刚石几乎不导电;而石墨晶体结构中碳原子排列成层状结构,在每层上,原子排列成六边形,层与层之间距离较大,各层之间相互作用力很弱,质地松软,可以用来制作粉状润滑剂、铅笔芯等,石墨具有良好的导电性.
4.晶体具有确定的熔点
(1)晶体的温度升高时,组成晶体的微粒运动加剧,当热运动达到足以破坏其空间排列的规律性时,晶体开始熔化,要破坏微粒空间排列的规律性就需要克服微粒的强大作用力做功.因为在晶体尚未全部熔化之前,吸收的热量全部用来破坏其空间排列的规律性,所以晶体熔化时有确定的熔点,虽然在熔化过程中不断地吸收热量,但温度并不升高,如果晶体全部熔化后仍吸收热量,温度将由熔点继续升高.
(2)晶体熔化时内能增大
晶体熔化时温度保持不变,分子的平均动能不变,晶体熔化过程中吸收的热量使分子间的距离增大,全部用来增加分子的势能.因为物体的内能是所有分子动能和分子势能的总和,所以晶体熔化时内能增大.

收藏《晶体和非晶体》文章
收藏《晶体和非晶体》文章