一、气体的等温变化
1、玻意耳定律
(1)内容:一定质量的某种气体,在温度不变的情况下,压强p与体积V成反比。即为玻意耳定律。
(2)表达式:p1V1=p2V2,或者pV=C(常数)。
(3)使用条件:
①气体质量不变、温度不变。
②气体温度不太低、压强不太大。
2、等温变化的两种图象
(1)p-1/V图象
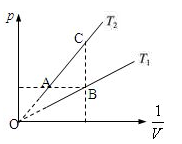
①一定质量的气体,温度不变时,pV=常量,p-1/V成正比,在图上的等温线应是过原点的直线。
②不同温度的等温线,温度越高(T1>T2),斜率越大,pV乘积越大。
(2)p-V图像
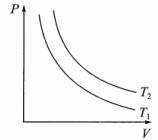
①一定质量的气体,温度不变时,pV=常量,p-V成反比,在图上的等温线应是是双曲线的一支。
②不同温度的等温线,温度越高(T1>T2),等温线越高,pV乘积越大。
二、气体的等容变化
1、查理定律
(1)内容:一定质量的某种气体,在体积不变的情况下,压强p与热力学温度T成正比。即为查理定律。
(2)表达式:p1/T1=p2/T2,或p1/p2=T1/T2,或者p/T=C(常数)。
(3)使用条件:
①气体的质量、体积保持不变;
②气体压强不太大,温度不太低。
2、等容变化的两种图象
(1)p-T图象
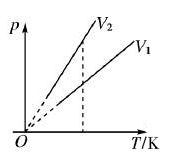
①在p-T图象中,一定质量的某种气体的等容线,图象是一条延长线过原点的倾斜直线;
②不同体积的等容线,体积越大(V1>V2),等容线斜率越小。
(2)p-t图像
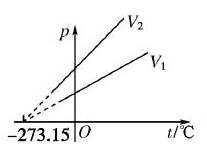
①在p-t图象中,一定质量的某种气体的等容线,图象是一条延长线不过原点的倾斜直线,在t轴的截距是-273.15℃。
②不同体积的等容线,体积越大(V1>V2),等容线斜率越小。
三、气体的等压变化
1、盖-吕萨克定律
(1)内容:一定质量的某种气体,在压强不变的情况下,体积V与热力学温度T成正比。即为盖-吕萨克定律。
(2)表达式:V1/T1=V2/T2,或V1/V2=T1/T2,或者V/T=C(常数)。
(3)使用条件:
①气体质量不变、压强不变;
②气体温度不太低、压强不太大。
2、等容变化的两种图象
(1)V-T图象
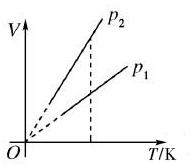
①在V-T图象中,一定质量的某种气体的等压线,图象是一条延长线过原点的倾斜直线;
②不同体积的等压线,压强越大(p1>p2),等压线斜率越小。
(2)V-t图像
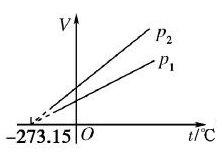
①在V-t图象中,一定质量的某种气体的等压线,图象是一条延长线不过原点的倾斜直线,在t轴的截距是-273.15℃。
②不同体积的等压线,压强越大(p1>p2),等压线斜率越小。
