波尔理论的基本假设
1、轨道量子化
电子绕核做周期性运动,却不辐射电磁波,因此这些状态是稳定的。
轨道半径为rn=n2r1(n=1,2,3…)
轨道最小半径r1=0.53×10-10m。

2、能量的量子化与定态
(1)基态与激发态
①能级:电子在不同的轨道上运动时,原子处于不同的状态,因而具有不同的能量,即原子的能量是不连续的、是量子化的,这些量子化的能量值叫做能级。
②定态:原子钟这些具有确定能量的稳定状态称为定态,在各个定态中,原子是稳定的,不向外辐射能量.
③基态与激发态:能量最低的状态叫基态,其他的状态叫激发态。基态的轨道半径最小。
(2)氢原子的能级
氢原子的各能级关系为:。
对于氢原子基态能量为E1=-13.6eV,其他各激发态的能量为-3.4eV,-1.51eV…
(3)氢原子的各能级关系如图所示

3、频率条件
(1)光子的发射与吸收
电子从基态跃迁到激发态时,要吸收能量,而从激发态跃迁到基态,则以光子的形式向外放出能量,无论是吸收能量还是放出能量,这个能量值不是任意的,而是由前后两个能级的能量差决定的,即hν=Em-En (m>n),这是光子发射和吸收的频率条件。
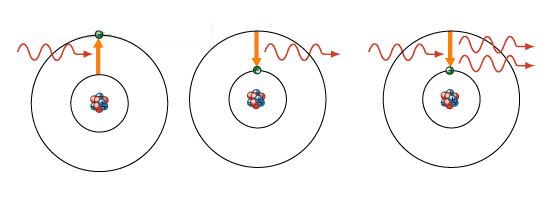
(2)原子的电离
若入射光子的能量大于原子的电离能,如基态氢原子的电离能为13.6ev,则原子也会被激发跃迁,这时核外电子脱离原子核的束缚,成为自由电子,光子,能量大于电离能的部分,变为自由电子的动能。
(3)原子能量的变化
当轨道半径减小时,库仑引力做正功,原子的电势能减小,电子的动能增加原子向外辐射光子,原子能量减小;反之轨道半径增大时,原子电势能增大,电子动能减小,原子吸收光子,原子能量增大。
